Поурочные разработки по химии 11 класс
Амфотерные органические и неорганические соединения - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: закрепить знание понятия «амфотерность», научить объяснять амфотерные свойства неорганических и органических соединений и составлять уравнения химических реакций; закрепить знание о комплексных соединениях; сделать выводы об относительности понятий «кислота» и «основание»; совершенствовать практические умения и навыки выполнения химического эксперимента, соблюдая правила ОТ и ТБ.
Основные понятия: амфотерность, амфотерные соединения, кислота, основание, комплексное соединение, относительность понятий «кислота» и «основание», полимер, полипептид, реакция поликонденсации.
Оборудование: набор реактивов, пробирки, NH, Н2O, AlCl3 — на столе учителя и для лабораторного опыта на столик учащихся.
Ход урока
I. Организационный момент
Постановка целей и задач урока.
II. Проверка правильности выполнения домашнего задания
Ответы на задания домашней работы
§ 21 № 2
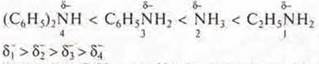
этиламин С2Н5 → NH2; δN- возрастает за счет радикала —С2Н5, его электронной плотности и электронной плотности двух атомов Н, обеспечивая сильное протонирование, основной характер.
NH3 — аммиак; δN- — усиление только электронной плотностью трех атомов Н, основной характер, т. е. протонирование слабее.
![]() — фениламин, ароматический амин, δN- уменьшается. т. к. неподеленная пара электронов азота вступает в сопряжение с 6е- π-облаком ароматического кольца, протонирование ослабевает. основной характер уменьшается.
— фениламин, ароматический амин, δN- уменьшается. т. к. неподеленная пара электронов азота вступает в сопряжение с 6е- π-облаком ароматического кольца, протонирование ослабевает. основной характер уменьшается.
![]() — дифениламин, ароматический амин: δN- уменьшается еще сильнее по сравнению с предыдущим, т. к. неподеленная пара электронов атома азота вступает в сопряжение с 6е- π-облаками двух ароматических колеи, протонирование очень слабое, основные свойства очень малы.
— дифениламин, ароматический амин: δN- уменьшается еще сильнее по сравнению с предыдущим, т. к. неподеленная пара электронов атома азота вступает в сопряжение с 6е- π-облаками двух ароматических колеи, протонирование очень слабое, основные свойства очень малы.
§ 21 № 3
Основные свойства в пределах одного периода у водородных соединений уменьшаются к концу периода, т. к. заряд ядра атома элемента возрастает постепенно, радиус иона элемента уменьшается, а С.О. элемента возрастает, протонирование ослабевает, усиливается кислотный характер — отдача протона.
Пример: водородные соединения элементов II периода:
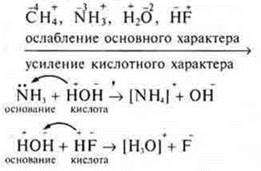
§ 21 № 4
Основные свойства летучих водородных соединений одной группы к концу группы, главной подгруппы ослабевают. С.О. элемента не изменяется, быстро растет заряд ядра атома иона элемента и возрастает радиус атома иона, ослабевает протонирование. усиливается отдача протона, т. е. кислотный характер.
VI группа, главная подгруппа
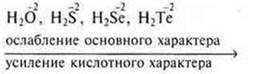
§ 21 № 5
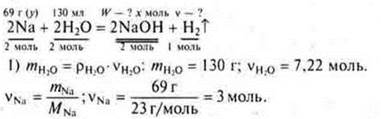
![]() моль Na требуется, а дано 3 моль ⇒ Na — недостаток. Расчет ведем по «недостатку».
моль Na требуется, а дано 3 моль ⇒ Na — недостаток. Расчет ведем по «недостатку».
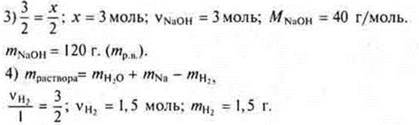
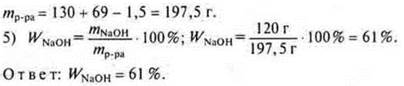
III. Изучение нового материала
План изложения:
1. Амфотерность, амфотерные неорганические соединения.
2. Лабораторный опыт. Получить амфотерный гидроксил алюминия и доказать его амфотерные свойства.
3. Составление обобщающих схем амфотерных соединений: оксидов и гидроксидов.
4. Амфотерные органические соединения.
5. Относительность понятий «кислота» и «основание».
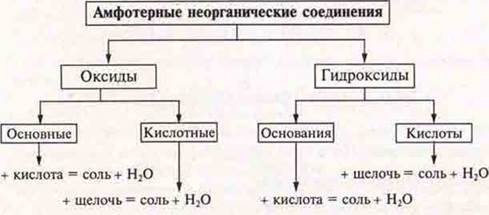
Амфотерность (переменность) — проявление соединением кислотных или основных свойств в зависимости от условий.
Амфотерные соединения — оксиды и гидроксиды, как правило, образованы переходными элементами.
Учащимся следует хорошо запомнить переходные элементы, которые чаще всего присутствуют в соединениях.
Элементы со С.О. +2 — Be, Zn; С.О. +3 — Al, Сr, Fe; С.О. +4 — Sn, Pb.
Они образуют оксиды и гидроксиды с кислотно-основными свойствами.
|
Элемент |
Оксид |
Гидроксид-основание |
Гидроксид-кислота |
|
Be |
|
Ве(ОН)2 |
Н2ВеO2 |
|
Zn |
|
Zn(OH)2 |
H2ZnO2 |
|
Al |
|
AlOH)3 |
H3AlO3 — алюминиевая кислота (ортоформа) НАlO2 - метаалюминиевая кислота (метаформа) |
|
Сr |
|
Сr(ОН)3 |
Н3СrO3 — хромовая кислота (ортоформа) НСrO12 - метахромовая кислота (метаформа) |
|
Pb |
|
Рb(ОН)4; РbО(ОН)2; (РbO · nН2O) |
Н4РbO4 (ортоформа) H2PbO3 (метаформа) |
Условия течения реакций:
— вещества берутся в твердом виде и спекаются. Как правило, образуются твердые соединения — метаформы или ортоформы;
— вещества берутся в растворах, образуются комплексные соединения.
Учитель напоминает учащимся о том, что с данными соединениями они познакомились при изучении темы «Классификация солей». В рабочих тетрадях есть записи об их строении, классификации и номенклатуре.
Учащиеся вместе с учителем приступают к выполнению лабораторного опыта получения амфотерного гидроксида алюминия и экспериментальному доказательству его амфотерности.
Эксперимент:
Получить гидроксид алюминия, имея АlСl3 и NH3 · H2O:
![]()
Наблюдение: выпадает полупрозрачный студенистый осадок — это гидроксид алюминия.
Учащиеся разделяют полученный Аl(ОН)3 на две пробирки. В одной они оставляют большую часть Аl(ОН)3; Аl(ОН)3 — очень слабая кислота, нерастворимая.
Эксперимент:
Для доказательства его кислотных свойств проводим реакцию Аl(ОН)3 с раствором щелочи.
Учащиеся добавляют NaOH к Аl(ОН)3, где меньшая часть.
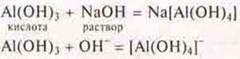
Наблюдение: осадок Аl(ОН)3 исчезает, образуется комплексное соединение.
Даем характеристику:
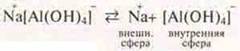
![]() — строение внутренней сферы:
— строение внутренней сферы:
![]() — комплексообразователь;
— комплексообразователь;
4(ОН)- — лиганды.
Координационное число (к. ч.) комплексообразователя — 4.
Это анионный комплекс, т. к. внутренняя сфера заряжена отрицательно. Название: тетра-гидроксо-алюминат натрия.
Эксперимент:
Для доказательства основных свойств Аl(ОН)3 проводим реакцию, добавляем к Al(ОН)3 кислоту более сильную:
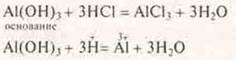
Наблюдение: осадок Аl(ОН)3 исчезает. Таким образом, мы экспериментально убедились в проявлении амфотерности — кислотно-основных свойств гидроксила алюминия.
Учитель заостряет внимание учащихся на аналогичности записи реакций и экспериментов с соединениями хрома, галлия и т. д. всех элементов со С.О. +3.
Далее учитель предлагает учащимся составить уравнения реакций, подтверждающие амфотерность оксида алюминия — быть основным и кислотным оксидом.
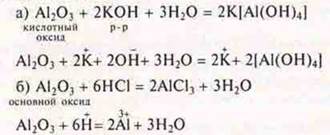
В случае спекания, применяя вещество в твердом виде, учитель записывает уравнения реакций:
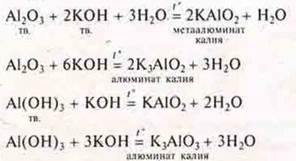
В качестве обобщения составляется схема:
В органической химии типичными амфотерными соединениями являются аминокислоты. Общая формула для α-аминокислот:
![]()
—:NH2— аминогруппа обеспечивает аминокислотам основные свойства, т. е. аминокислоты взаимодействуют с кислотами.
Пример:
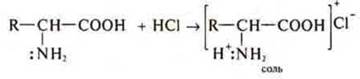
—СООН — карбоксильная группа обеспечивает аминокислотам кислотные свойства. Они взаимодействуют как кислоты с щелочами, солями, металлами, оксидами металлов.
Пример:
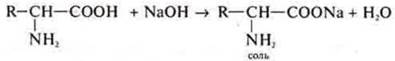
Если аминокислоты в растворе, то они диссоциируют с образованием биполярного иона:
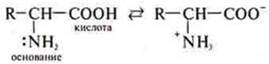
Самое главное — за счет амфотерности аминокислот на клеточном уровне идет их взаимодействие друг с другом, образуются полипептиды — белки:
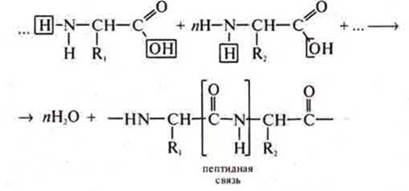
Общая формула полипептида:
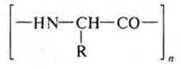
В промышленности в результате реакции поликонденсации из аминокислот с концевыми расположениями групп —NH2 и —СООН синтезируют полимеры — синтетические волокна. Пример: волокно капрон.
В конце изучения вопроса амфотерности соединений учитель поясняет учащимся относительность понятий «кислота» и «основание» на примере взаимодействия воды с аммиаком.
В этой реакции вода— кислота, т. к.отдает протон (протолитическая теория), а аммиак — основание, т. к. принимает протон (протолитическая теория), предоставляет неподеленную пару электронов — донор, тоже основание (электронная теория):
![]()
При взаимодействии воды с кислотами, в случае диссоциации кислот, по тем же причинам вода — основание:
![]()
Вопрос этот сложный для восприятия в обычных классах. Желательно эти сведения предложить учащимся с повышенной мотивацией к обучению.
Если расположить соединения в порядке увеличения их кислотных свойств, то получится ряд:
NH3 < N2H4 < Н2O < HCN < H2S < СН3СООН < Н3РO4 < HF < HNO3 < HCl < H2SO4 < HBr < НСlO4.
Получается, каждое вещество этого ряда, за исключением крайних, проявляет амфотерность, в зависимости от того, с каким веществом оно взаимодействует. Относительно деления кислот на сильные и слабые, и оснований на сильные и слабые: все зависит от того, с какими растворителями взаимодействует.
Пример: при растворении слабой кислоты СН3СООН в воде она выступает в роли кислоты:
![]()
А если растворять ее в серной кислоте, то она выступает как основание:
![]()
СН3СООН — слабая кислота, при растворении в Н2O диссоциирует мало, но при растворении в NH3 (жидком), который как основание сильнее воды, СН3СООН диссоциирует намного сильнее, оказывается такой же сильной, как серная кислота в воле.
Спирты в водных растворах кислотных свойств не проявляют, а вот в NH3 жидком проявляют кислотные свойства:
![]()
Таким образом, одним из важных выводов протонно-электронной теории кислот и оснований является относительность понятий «кислота» и «основание».
III. Домашнее задание
§ 22 № 2, 3, 4; подготовиться к практической работе № 4 по теме «Гидроксиды».