Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Задания с комментариями и решениями - ОСНОВЫ ХИМИИ
Задание 1. Хлорид-иону соответствует электронная формула
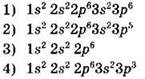
Вспомним, что ионы — это заряженные частицы. Формула хлорид-иона Сl-. Заряд минус указывает на то, что к атому хлора присоединился 1 электрон. В Периодической системе хлор расположен в 3-м периоде VIIA, группе. Электронная конфигурация атома Cl: 1s22s22p63s23p5.
После присоединения 1 электрона атом хлора превращается в хлорид-ион, электронная конфигурация которого: 1s22s22p63s23p6.
Ответ: 1
Задание 2. Атому, электронная конфигурация внешнего уровня которого ns2np3, соответствует общая формула высшего оксида
![]()
Вспомним, что суммарное число электронов на внешнем энергетическом уровне, как правило, равно максимальной степени окисления атома. В свою очередь, максимальная степень окисления элемента почти всегда соответствует номеру группы, в которой этот элемент расположен.
Согласно условию задания сумма электронов на внешнем уровне атома равна 5 (2 + 3), следовательно, максимальная степень окисления равна +5. Учитывая, что степень окисления кислорода в оксидах равна -2, составляем формулу высшего оксида: R2O5.
Ответ: 2
Задание 3. Число электронов в атоме элемента 2-го периода, общая формула водородного соединения которого RH4, равно
1) 8
2) 2
3) 6 .
4) 4
Вначале определим высшую степень окисления элемента (или валентность), образующего водородное соединение: она равна -4. Следовательно, элемент расположен во втором периоде 4-й группе: это углерод. Порядковый номер 6, и суммарное число электронов равно 6.
Ответ: 3
Задание 4. Иону Мn2+ соответствует электронная конфигурация внешнего энергетического уровня
1) 3s23p6
2) 3s23p4
3) 4s23d3
4) 3s23p5
Анализ вариантов ответов начнем с определения положения марганца в Периодической системе химических элементов: марганец является элементом 4-го периода УПБ группы. Это означает, что у него заполняются электронами 3d- и 4s-подуровни. В основном состоянии строению атома марганца соответствует электронная конфигурация внешнего уровня 4s23d5. С учетом заряда иона, который свидетельствует об отдаче двух электронов атомом, заряд иона марганца равен 2+, следовательно, электронная конфигурация внешнего энергетического уровня 4s23d3.
При решении данного задания можно исходить и из суммарного числа электронов в атоме марганца. Его можно определить по порядковому номеру — 25. Вычтя из 25 два (заряд иона), приходим к выводу, что в ионе марганца (Мn2+) 23 электрона. У атома аргона (порядковый номер 18), имеющего завершенную конфигурацию третьего энергетического уровня, всего 18 электронов и строение внешнего уровня 3s23p6. Добавив еще 5 электронов (2 на 4s и 3 на 3d-подуровни), приходим к той же электронной конфигурации 4s23d3.
Ответ: 3
Задание 5. В ряду элементов Mg → Са → Sr
1) уменьшается радиус атомов
2) возрастает способность атомов отдавать электроны
3) уменьшается число энергетических уровней
4) увеличивается электроотрицательность
Химические элементы, приведенные в данном ряду, находятся во НА группе и расположены в порядке увеличения их атомных номеров (по группе сверху вниз). Согласно закономерности изменения свойств по группе с увеличением номера периода увеличивается число энергетических уровней в атомах, возрастает атомный радиус элементов и, как следствие этого, увеличивается легкость отдачи валентных электронов, а способность притягивать электроны, т.е. электроотрицательность элементов, ослабевает. Следовательно, правильный ответ 2.
Ответ: 2
Задание 6. Наиболее сильные кислотные свойства проявляет водородное соединение
1) Н2O .
2) NH3 .
3) H2S
4) РН3
Определим положение неметаллов, образующих соединения с водородом в Периодической системе. Азот и фосфор — элементы V группы, кислород и сера — элементы VI группы. Кроме того, азот и кислород — элементы 2-го периода, фосфор и сера — элементы 3-го периода.
В периоде с возрастанием электроотрицательности центрального атома кислотные свойства водородных соединений возрастают слева направо. Значит, вода проявляет более сильные кислотные свойства, чем аммиак, а сероводород — более сильная кислота, чем фосфин.
По группе кислотность водородных соединений возрастает сверху вниз вместе с уменьшением прочности связи элемент — водород. Следовательно, кислотные свойства фосфина более выражены, чем у аммиака, а у сероводорода — более выражены по сравнению с водой.
Сопоставляя все сказанное, приходим к выводу, что наиболее сильные кислотные свойства проявляет сероводород.
Ответ: 3
Задание 7. Водородная связь образуется между молекулами
1) С2Н2 .
2) СН3СООН
3) СН3Сl .
4) СН3СНО
Напомним, что водородная связь образуется между положительно заряженным атомом водорода и отрицательно заряженными атомами наиболее электроотрицательных элементов (F, О, N):
![]()
Из перечисленных веществ только в молекуле уксусной кислоты, в которой атом кислорода интенсивно смещает к себе электронную плотность от атома водорода, образуется большой положительный заряд. Во всех остальных случаях атом водорода связан ковалентной связью с атомом углерода, а эта связь малополярна из-за близости электроотрицательности этих двух элементов. Таким образом, водородная связь может реализоваться только между молекулами уксусной кислоты.
Ответ: 2
Задание 8. Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) вода и сероводород
2) бромид калия и азот
3) аммиак и водород
4) кислород и метан
Обратим внимание на слово “соответственно”, которое подчеркивает, что вещества с соответствующими видами связи должны быть расположены в паре в указанном порядке.
Составим формулы названных веществ:
![]()
Ковалентная неполярная связь образуется фактически между атомами одного и того же элемента, т.е. в молекулах простых веществ-неметаллов. Поэтому исключим вариант ответа 1, в котором оба вещества являются сложными. Не может быть правильным и ответ 4, т.к. вещество с ковалентной неполярной связью записано в нем первым.
Ковалентная полярная связь образуется в сложных веществах между атомами, несильно различающимися по электроотрицательности. Этому критерию не соответствует вариант ответа 2, т.к. фторид кальция — вещество с ионной связью.
Ответ: 3
Задание 9. В каком ряду все вещества имеют ковалентную полярную связь?
![]()
Проанализируем все варианты ответов “по вертикали”, т.е. обратим вначале внимание на первые вещества каждого ряда, затем вторые и т.д.
Отмечаем, что в молекуле кислорода связь ковалентная неполярная, а в бромиде натрия — ионная. Значит, варианты ответов 2 и 4 уже не являются правильными, поскольку, согласно условию задания, все три вещества ряда должны иметь ковалентную полярную связь.
В варианте ответа 1 оксид калия также имеет ионную связь. Остается ответ 3, где все три вещества образованы атомами неметаллов с разной электроотрицательностью, т.е. имеют ковалентные полярные связи.
Ответ: 3
Задание 10. Тремя общими электронными парами образована ковалентная связь в молекуле
1) азота .
2) этилена
3) сероводорода.
4) метана
Для выполнения задания целесообразно вспомнить строение атомов, образующих указанные в задании вещества, составить молекулярные, а еще лучше структурные формулы веществ.
Атом азота с электронной конфигурацией валентных электронов 2s22p3 имеет три неспаренных электрона. За счет спаривания этих электронов с тремя электронами другого атома азота образуется молекула N2, содержащая тройную связь (три общие электронные пары):
![]()
Это и есть верный ответ. Но необходимо проверить и другие варианты ответа.
Формула этилена Н2С = СН2. Углерод четырехвалентен. Две связи каждого из атомов углерода образуются с водородом, а еще двумя связями атомы углерода соединены между собой. Ответ неверный.
Атом серы имеет два неспаренных электрона, которые участвуют в образовании двух химических связей с атомами водорода. Всего в молекуле H2S две связи, но каждая связь — одинарная (т.е. образованная одной электронной парой):
Н—S—Н
Атом углерода в молекуле СН4 образует 4 ковалентные связи, и каждая из этих связей образована одной парой электронов.
Ответ: 1
Задание 11. Только σ-связями соединены атомы в молекуле
1) СН3ОН .
2) СO2 .
3) С2Н2
4) С2Н4
Для нахождения правильного ответа изобразим структурные формулы этих соединений:
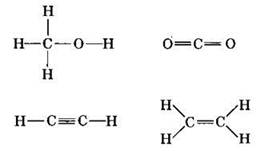
Напомним, что между каждой парой связанных атомов существует единственная σ-связь. В первой молекуле всего пять химических связей, причем все они σ-типа. Во второй молекуле всего четыре связи, но к σ-типу относятся только две из них. В третьей молекуле пять связей, но σ-связей из них только три. В последней молекуле из шести химических связей пять σ-связей:
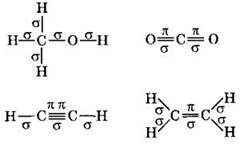
Ответ: 1
Задание 12. Степень окисления углерода в СН3Сl равна
1) +1 .
2) -1
3) +2 .
4) -2
Для начала вспомним, что степень окисления — это условный заряд, который возник бы на атоме в предположении, что все связи в соединении ионные (т.е. все связывающие электронные пары полностью смещены к более электроотрицательному атому). Приведем структурную формулу хлорметана, в которой мысленно сместим все связывающие электронные пары к более электроотрицательным атомам:

Атом углерода, будучи более электроотрицательным по сравнению с водородом, смещает к себе все три связывающие электронные пары С—Н связей. Атом хлора, будучи более электроотрицательным, чем углерод, смещает к себе электронную пару связи С—Сl. Следовательно, у атома углерода при таком способе деления электронных пар имеются 6 электронов, в то время как валентных всего 4 — т.е. имеются 2 “лишних” электрона. Эти “лишние” электроны и создают на атоме углерода условный заряд -2. Легко найти далее степени окисления атома водорода (+1) и атома хлора (-1). Сумма степеней окисления всех атомов равна нулю, что говорит о правильности ответа.
Ответ: 4
Задание 13. Степень окисления азота в ионе NH4+ равна
1) -1 .
2) -3
3) +3 .
4) +5
Ход рассуждений при выполнении этого задания может быть аналогичным тому, что и в случае предыдущего задания. Но можно подойти и иначе. Азот как более электроотрицательный по сравнению с водородом элемент имеет отрицательную степень окисления (х), а водород — положительную, равную +1. Составим уравнение, согласно которому сумма всех степеней окисления должна дать значение заряда иона аммония:
х + 4 ∙ 1 = +1,
отсюда х = -3, т.е. степень окисления азота в ионе аммония такая же, как в молекуле аммиака.
Ответ: 2
Задание 14. К кислотным относится высший оксид
1) бария .
2) хрома
3) алюминия .
4) цинка
Известно, что металлы IA и IIА группы образуют высшие оксиды с основными свойствами (кроме оксида бериллия).
Оксид бария — основный оксид.
Алюминий — элемент IIIА группы со степенью окисления +3, образует амфотерный оксид.
Кислотные свойства могут проявлять оксиды металлов побочных подгрупп в высшей степени окисления. Чем выше степень окисления элемента, тем более кислотными свойствами обладают его соединения.
Цинк относится к элементам IIВ группы и проявляет только одну степень окисления, равную +2. Его высший оксид (ZnO) обладает амфотерными свойствами.
Хром проявляет несколько степеней окисления: +2, +3, +6. Ему соответствуют три оксида хрома. Согласно указанному выше правилу они проявляют следующие свойства: СrО — основный оксид, Сr2O3 — амфотерный оксид, СrO3 — кислотный оксид.
Ответ: 2
Задание 15. Степень окисления марганца в его амфотерных соединениях равна
1) +7
2) +2
3) +3 .
4) +1
Как правило, соединения металлов (оксиды, гидроксиды) в наименьшей степени окисления, равной +1 и +2, проявляют преимущественно основные свойства, если +3 и +4, то амфотерные, +5 и выше — кислотные. Следовательно, степень окисления марганца: в его основном оксиде МnО — наименьшая +2, в кислотном оксиде Мn2O7 — максимальная, равная +7, в амфотерном оксиде МnO2 — промежуточная, равная +4.
Ответ: 3
Задание 16. Взаимодействие магния с сульфатом меди(II) относится к реакции
1) обмена .
2) соединения
3) разложения .
4) замещения
Это одно из наиболее типичных заданий, проверяющих знание основ классификации химических реакций. Для точного ответа целесообразно составить уравнение реакции:
Mg + CuSO4 = MgSO4 + Сu
Затем необходимо вспомнить особенности типов химических реакций, указанных в условии. После этого легко определить, что указанная в условии задания реакция относится к реакциям замещения, т.к. атомы простого вещества (магния) замещают один из элементов (медь), входящих в состав сложного вещества (сульфата меди (II)).
Ответ: 4
Задание 17. Взаимодействие карбоновой кислоты и спирта относится к реакциям
1) присоединени.
2) этерификации.
3) гидролиза
4) дегидратации
5) обратимым
Запишем уравнение этой реакции в общем виде:
![]()
По уравнению видно, что в реакцию вступают два вещества и получаются два вещества. Это означает, что данный процесс не относится к реакциям присоединения и к реакциям дегидратации (разновидность реакций разложения). А так как вода не вступает в реакцию, следовательно, это не гидролиз. Образование в результате реакции сложного эфира и воды позволяет сделать вывод, что это реакция этерификации (образования эфира).
Возможность протекания реакции и в прямом и в обратном направлении указывает на то, что это реакция обратимая.
Ответ: 25
Задание 18. Реакция, уравнение которой ![]() относится к реакциям
относится к реакциям
1) замещения .
2) разложения .
3) присоединения.
4) обмена
5) экзотермическим
6) эндотермическим
Натрий — активный металл (см. ряд напряжений металлов), поэтому его взаимодействие с водой является реакцией экзотермической. Натрий быстро перемещается по поверхности воды, плавится от теплоты, выделяющейся в ходе реакции, и в конце даже может загореться. Таким образом, правильный ответ следует искать среди первых двух вариантов. По другому классификационному признаку можно сделать заключение, что это — реакция замещения: реагирует простое и сложное вещество и получается простое и сложное вещество.
Ответ: 15
Задание 19. Скорость прямой реакции ![]() возрастает при
возрастает при
1) увеличении концентрации азота
2) понижении температуры
3) увеличении концентрации аммиака
4) уменьшении концентрации водорода
5) повышении температуры
В соответствии с законом действующих масс скорость химической реакции пропорциональна концентрации реагентов. Следовательно, неверными являются ответ 3, т.к. увеличение концентрации аммиака — продукта реакции никак не скажется на скорости прямой реакции, и ответ 4, где говорится об уменьшении концентрации водорода — одного из реагентов. Увеличению скорости реакции способствует повышение температуры, значит, неверным является и вариант ответа 2.
Еще одним фактором, способствующим увеличению скорости протекания химической реакции, является повышение температуры.
Ответ: 15
Задание 20. С наибольшей скоростью при обычных условиях протекает реакция
![]()
Проанализируем предложенные варианты. Для начала сравним ответы 1 и 4. Барий относится к наиболее активным металлам. При нагревании на воздухе он эффектно сгорает, соединяясь с кислородом, но в любом случае это не самая быстрая реакция. С серой барий будет реагировать намного медленнее, чем с кислородом.
Барий очень бурно взаимодействует с раствором кислоты (ответ 3). Но еще более быстрой является реакция между водными растворами солей бария и угольной кислоты. Осадок карбоната бария выпадает мгновенно. И это — не только особенность солей бария. Установлено, что с наибольшими скоростями протекают именно реакции в растворах электролитов — реакции нейтрализации, выпадения осадков и подобные им.
Ответ: 2
Задание 21. Химическое равновесие в системе ![]() смещается в сторону образования продукта реакции при
смещается в сторону образования продукта реакции при
1) повышении давления
2) увеличении концентрации NO2
3) повышении температуры
4) применении катализатора
5) повышении концентрации O2
Проанализируем влияние каждого фактора на состояние равновесия в данной реакционной системе, применив принцип Ле-Шателье.
Данная реакция протекает с уменьшением объема системы (из 3 моль газа образуется 2 моль). Следовательно, повышение давления (ответ 1) сместит равновесие в сторону меньшего объема, т.е. в сторону образования продукта реакции.
Данная реакция экзотермическая. Увеличение температуры (ответ 3) приводит к смещению равновесия в сторону эндотермической реакции, т.е. в сторону исходных веществ.
Увеличение концентрации продукта реакции NO2 (ответ 2) приведет к смещению равновесия также в сторону исходных веществ. А вот повышение концентрации O2, т.е. исходного вещества, приведет к смещению химического равновесия именно в сторону продуктов реакции.
Таким образом, повышение давления и увеличение концентрации O2 будет способствовать смещению равновесия вправо, т.е. в сторону образования продукта реакции.
Ответ: 15
Задание 22. Сильным электролитом в водном растворе является
1) Н2СO3 .
2) СН3ОН
3) СН3СООН .
4) HCOONa
Вначале выясним, все ли предложенные в задании вещества являются электролитами, т.е. при растворении в воде и расплавлении распадаются на ионы — диссоциируют. Метиловый спирт (ответ 2) электролитом не является. Согласно условию задания, необходимо определить сильный электролит, т.е. электролит, полностью диссоциирующий на ионы.
Обе кислоты — угольная и уксусная — слабые (ответ 1 и 3). Угольная кислота практически представляет собой раствор углекислого газа в воде. Уксусная кислота, как и большинство органических кислот, по причине невысокой полярности связи О—Н диссоциирует обратимо.
Соль — формиат натрия, как и многие другие соли, в растворе полностью распадается на ионы. Это и есть сильный электролит.
Ответ: 4
Задание 23. Наиболее слабым электролитом является
1) HF
2) НСl
3) НВr
4) HI
В ряду HF—НСl—НВr—HI из-за увеличения радиуса атомов галогенов закономерно увеличивается и длина связи. Увеличение длины связи неминуемо приводит к уменьшению ее прочности. То есть самая короткая связь Н—F является самой прочной, а самая длинная связь Н—I — самая непрочная. Чем меньше прочность связи, тем легче она разрывается, тем больше степень электролитической диссоциации. Итак, в ряду галогеноводородных кислот HF—НСl—НВr—HI сила электролитов увеличивается. Самый слабый электролит — HF, а самый сильный — HI.
Ответ: 4
Задание 24. Установите соответствие между формулой соли и ее способностью к гидролизу.
|
ФОРМУЛА СОЛИ |
СПОСОБНОСТЬ К ГИДРОЛИЗУ |
|
|
1) гидролизуется по катиону |
|
2) гидролизуется по аниону |
|
|
3) гидролизуется по катиону и аниону |
|
|
4) не гидролизуется |
Рассмотрим отношение к гидролизу четырех предложенных солей.
1) CuSO4 образован слабым основанием и сильной серной кислотой, такие соли подвергаются гидролизу по катиону.
2) Na2CO3 образован сильным основанием и слабой угольной кислотой, такие соли подвергаются гидролизу по аниону.
3) Fe(NO3)3образован слабым основанием и сильной азотной кислотой, такие соли подвергаются гидролизу по катиону.
4) Al2S3 образован слабым основанием и слабой сероводородной кислотой, такие соли подвергаются гидролизу и по катиону, и по аниону.
Напомним также, что не гидролизуются соли, образованные сильным основанием и сильной кислотой.
Ответ: 1211
Задание 25. Установите соответствие между формулой вещества и продуктом, который образуется на инертном аноде в результате электролиза его водного раствора.
|
ФОРМУЛА ВЕЩЕСТВА |
ПРОДУКТ НА АНОДЕ |
|
|
|
|
А |
Б |
В |
Г |
При выполнении этого задания надо учитывать, что на аноде разряжаются анионы. Продукты электролиза зависят от состава аниона. Так, например, галогеноводородные кислоты (кроме HF) разряжаются с образованием простых веществ— галогенов, а в случае кислородсодержащих анионов и фторид-аниона — воды с выделением кислорода. При электролизе сульфид-ионов на аноде образуется сера. Устанавливаем соответствие: А — 2, Б — 1, В — 2, Г — 4.
Ответ: 2124
Задание 26. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
В начале выполнения задания проанализируем состав известных веществ и спрогнозируем состав веществ, недостающих в реакции.
Гипохлорит калия — соль слабой хлорноватистой кислоты, проявляющей сильные окислительные свойства.
Исходя из известных продуктов реакций, можно утверждать, что не хватает хлорсодержащего продукта, в котором степень окисления хлора будет ниже, чем +1. Такой устойчивой степенью окисления является -1, т.е. недостающее вещество содержит хлорид-ион.
Таким образом, недостающим продуктом реакции может быть хлороводород или хлорид калия (кроме К+ и Н+ других катионов в реакции нет). Однако гипохлорит устойчив в щелочной среде. Поэтому продуктом реакции будет хлорид калия, а исходным веществом гидроксид калия.
С учетом сделанных выводов составляем схему процесса:
![]()
Составляем электронный баланс:
![]()
С учетом баланса расставляем коэффициенты в уравнении реакции:
![]()
Определяем, что азот в степени окисления +2 (или оксид азота за счет азота +2) является восстановителем, а хлор в степени окисления +1 (или гипохлорит калия за счет хлора +1) — окислителем.


