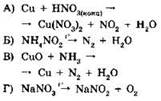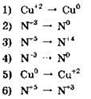Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Окислительно-восстановительные реакции. Окислители и восстановители
Окислительно-восстановительными называют реакции, протекающие с изменением степеней окисления элементов, входящих в состав реагирующих веществ. Именно окислительно-восстановительные реакции лежат в основе жизнедеятельности организма, с ними связаны процессы дыхания и обмена веществ в живых организмах, фотосинтез в растениях, их используют для получения металлов, кислот, солей и других ценных продуктов. Реакции электролиза и коррозии также относятся к окислительно-восстановительным. Наконец, эти реакции лежат в основе работы гальванических элементов, аккумуляторов и топливных элементов, превращающих химическую энергию в электрическую.
Окисление с точки зрения электронной теории — процесс отдачи электронов атомами, молекулами или ионами:
При окислении степень окисления элемента повышается.
Восстановление — процесс присоединения электрона атомом, молекулой или ионом:
При восстановлении степень окисления элемента понижается.
Восстановитель — элемент, отдающий электроны (или вещество, содержащее такой элемент). Восстановитель в ходе реакции окисляется.
Окислитель — элемент, принимающий электроны (или вещество, содержащее такой элемент). Окислитель в ходе реакции восстанавливается.
Классификация окислительно-восстановительных реакций
Все окислительно-восстановительные реакции принято делить на четыре типа.
1. Реакции межмолекулярного окисления-восстановления. В подобных реакциях восстановитель и окислитель — разные химические элементы, находящиеся в разных реагентах, например:

2. Реакции внутримолекулярного окисления и восстановления. В этих реакциях окислитель и восстановитель — разные химические элементы, но входящие в состав одного вещества, например:

3. Реакции диспропорционирования. Так называются реакции, в которых и окислитель, и восстановитель — один и тот же химический элемент, входящий в состав одного вещества:
![]()
Здесь хлор в степени окисления 0 является и окислителем (понижая степень окисления до -1), и восстановителем (повышая степень окисления до +5). Недаром раньше подобные реакции называли реакциями самоокисления-самовосстановления.
4. Реакции сонропорционирования*. Реакции сопропорционирования являются обратными по отношению к реакциям диспропорционирования и являются частным случаем реакций межмолекулярного окисления-восстановления. Примером такой реакции может быть взаимодействие хлорида аммония и нитрита натрия, лежащее в основе лабораторного способа получения азота:
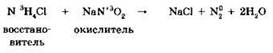
Типичные восстановители и окислители
К типичным восстановителям могут быть отнесены:
— простые вещества — металлы (наиболее сильные восстановители из них — щелочные и щелочноземельные);
— некоторые простые вещества — неметаллы (например, водород и углерод);
— производные элементов в низших или невысоких степенях окисления (например, H2S, SO2, СО, СН4, HI, NH3, H3PO3, SnCl2, FeCl2);
— многие органические соединения (альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза).
К типичным окислителям относятся:
— галогены;
— кислород O2, озон О3, пероксиды (Н2O2);
— производные элементов в высшей или достаточно высокой степени окисления (например, КМnO4, K2Cr2O7, HN03, РbO2);
— кислородные соединения галогенов (Сl2O, СlO2, КСlO, КСlO3).
Очевидно, что элемент в высшей степени окисления может проявлять только окислительные свойства, в то время как элемент в низшей степени окисления — только восстановительные. Производные в промежуточной степени окисления могут быть как окислителями, так и восстановителями, например:
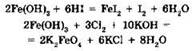
Видно, что в первой реакции железо(III) проявляет свойства окислителя и восстанавливается до железа(II), в то время как во второй — свойства восстановителя, окисляясь до железа(VI).
Подбор коэффициентов в уравнениях окислительно-восстановительных реакций
Для подбора коэффициентов в сложных уравнениях окислительно-восстановительных реакций на первых порах используют в основном метод электронного баланса. Его суть заключается в том, что число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. Покажем на примере, как это можно сделать.
Пусть необходимо расставить коэффициенты в уравнении реакции, схема которой:
![]()
1. Находим элементы, изменившие степень окисления. В данном примере это фосфор и азот.
|
Элемент |
Степень окисления |
Степень окисления |
|
в исходных веществах |
в продуктах |
|
|
Р |
0 |
+5 |
|
N |
+5 |
+2 |
2. Атом фосфора в степени окисления 0 в ходе реакции превращается в фосфор в степени окисления +5, отдавая 5 электронов. Атом азота в степени окисления +5 превращается в азот в степени окисления +2, принимая 3 электрона. Сказанное кратко записываем в виде схемы:
![]()
Следовательно, фосфор (0) — восстановитель, азот (+5) — окислитель:

3. Для того чтобы число электронов, отданных фосфором(0), было бы равно числу электронов, принятых азотом(+5), необходимо всю первую строчку умножить на 3, а вторую на 5:
![]()
4. Найденные главные коэффициенты переносим в схему реакции:
![]()
5. Подсчёт числа атомов водорода показывает, что в левой части уравнения имеется 5 атомов водорода, а в правой — 9. Следовательно, в левую часть уравнения необходимо добавить 4 атома водорода. Сделать это можно, только добавив в левую часть 2 молекулы воды:
![]()
6. Окончательная проверка правильности расставленных коэффициентов проводится по числу атомов кислорода: и в левой части уравнения, и в правой части уравнения одинаковое число атомов кислорода (17), что говорит о правильности подбора коэффициентов.
Задания
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. К окислительно-восстановительным относится реакция:
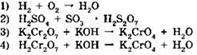
2. К окислительно-восстановительным относится реакция:

3. В какой из представленных реакций сера является восстановителем?

4. Окислительно-восстановительной является реакция, уравнение которой:
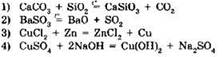
5. Окислительно-восстановительной не является реакция:
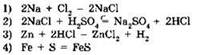
6. Реакции, уравнение которой
![]()
соответствует схема превращения азота:
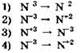
7. В какой реакции оксид серы(IV) является восстановителем?
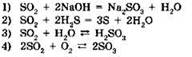
8. В реакции оксида хрома(III) с алюминием восстановительные свойства проявляет
![]()
9. Только восстановительные свойства проявляет
1) фосфор
2) бром
3) магний
4) сера
При выполнении заданий выберите правильные ответы. Установите соответствие.
10. К окислительно-восстановительным относятся реакции:

Ответ: ____ .
11. Процессы окисления представлены схемами:
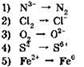
Ответ: ____ .
12. Азотная кислота является окислителем в реакциях, схемы которых:
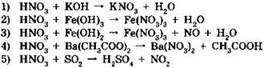
Ответ: ____ .
13. Серная кислота является окислителем в реакциях, схемы которых:
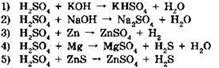
Ответ: ____ .
14. Серная кислота является окислителем в реакциях, схемы которых:
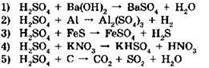
Ответ: ____ .
15. Одновременно и окислительные, и восстановительные свойства хлор проявляет в реакциях:
![]()
![]()
Ответ: ____ .
16. Фосфор проявляет свойства окислителя в реакциях:
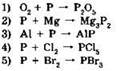
Ответ: ____ .
17. Сероводород проявляет свойства окислителя в реакциях:
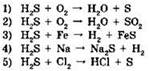
Ответ: ____ .
18. Установите соответствие между уравнением реакции и веществом-окислителем, участвующим в данной реакции.
|
УРАВНЕНИЕ РЕАКЦИИ
|
ОКИСЛИТЕЛЬ
|
|
А |
Б |
В |
Г |
19. Установите соответствие между схемой химической реакции и изменением степени окисления окислителя в ней.
|
СХЕМА РЕАКЦИИ
|
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
|
|
А |
Б |
В |
Г |
* Реакции диспропорционирования и сопропорционирования иногда называют реакциями дисмутации и конмутации.