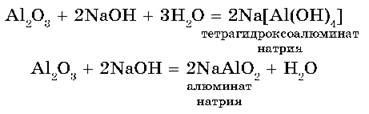Химия - Универсальный справочник школьника подготовка к ЕГЭ
Оксиды - Характерные химические свойства неорганических веществ различных классов - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (-2).
Общая формула оксидов: ЭmOn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды могут быть твердыми (песок SiO2, разновидности кварца), жидкими (оксид водорода H2O), газообразными (оксиды углерода: углекислый CO2 и угарный CO газы). По химическим свойствам оксиды подразделяются на солеобразующие и несолеобразующие.
- ЗАПОМНИ. В названиях всех оксидов сначала указывают слово «оксид», затем название второго элемента, которым он образован. Если элемент образует несколько оксидов, то в скобках указывают степень его окисления.
Несолеобразующими называются такие оксиды, которые не взаимодействуют ни со щелочами, ни с кислотами и не образуют солей. Их немного, в состав входят неметаллы.
Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
Среди солеобразующих оксидов различают оксиды основные, кислотные, амфотерные.
Основные оксиды — это такие оксиды, которым соответствуют основания. Например: CuO соответствует основание Cu(OH)2, Na2O — основание NaOH, Cu2O — CuOH и т. д.
Типичные реакции основных оксидов:
1. Основный оксид + кислота → соль + вода (реакция обмена):
CuO + 2HNO3 = Cu(NO3)2 + H2O
2. Основный оксид + кислотный оксид → соль (реакция соединения):
![]()
3. Основный оксид + вода → щелочь (реакция соединения):
K2O + H2O = 2KOH
Кислотные оксиды — это такие оксиды, которым соответствуют кислоты. Это оксиды неметаллов: N2O5 соответствует HNO3, SO3 — H2SO4, CO2 — H2CO3, P2O5 — H3PO4, а также оксиды металлов с большим значением степеней окисления: ![]() соответствует H2CrO4,
соответствует H2CrO4, ![]() — HMnO4.
— HMnO4.
Типичные реакции кислотных оксидов:
1. Кислотный оксид + основание → соль + вода (реакция обмена):
SO2 + 2NaOH = Na2SO3 + H2O
2. Кислотный оксид + основный оксид → соль (реакция соединения):
CaO + CO2 = CaCO3
3. Кислотный оксид + вода → кислота (реакция соединения):
N2O5 + H2O = 2HNO3
Такая реакция возможна, только если кислотный оксид растворим в воде.
Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Это ZnO, Al2O3, Cr2O3, V2O5. Амфотерные оксиды с водой непосредственно не соединяются.
Типичные реакции амфотерных оксидов:
1. Амфотерный оксид + кислота → соль + вода (реакция обмена):
ZnO + 2HCl = ZnCl2 + H2O
2. Амфотерный оксид + основание → соль + вода или комплексное соединение: