Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Классификация и номенклатура органических веществ - Теоретический материал - ОРГАНИЧЕСКАЯ ХИМИЯ
По составу и строению органические вещества условно можно отнести к трем группам: углеводороды, кислородсодержащие и азотсодержащие соединения.
Особенности строения и свойств находят свое отражение и в системе названия веществ — номенклатуре. Наиболее используемыми видами номенклатуры являются: систематическая и тривиальная.
Таблица 6
|
Класс соединений |
Общая формула гомологического ряда |
Примеры веществ и их названий |
|
Углеводороды |
||
|
Алканы |
|
этан |
|
Циклоалканы |
|
циклобутан |
|
Алкены |
|
бутен-1 |
|
Алкадиены (диены) |
|
бутадиен-1,3 |
|
Алкины |
|
пропин |
|
Ароматические (арены) |
|
бензол |
|
Кислородсодержащие соединения |
||
|
Спирты |
|
этанол |
|
Фенолы |
(где m — число групп —ОН) |
фенол |
|
Простые эфиры |
|
диэтиловой эфир |
|
Альдегиды и кетоны |
|
этаналь |
|
Карбоновые кислоты |
|
пропановая кислота |
|
Сложные эфиры |
|
этиловый эфир уксусной кислоты (этилацетат) |
|
Углеводы |
|
глюкоза или фруктоза |
|
Азотсодержащие соединения |
||
|
Нитросоединения |
|
нитроэтан |
|
Амины |
|
метиламин |
|
Аминокислоты |
|
аланин |
|
Белки |
биополимеры |
гемоглобин |
Единственным веществом, рассматриваемым в группе “фенолы”, является сам фенол, имеющий формулу С6Н5ОН.
Рассмотрим правила образования названий органических веществ по систематической номенклатуре.
При составлении названий органических веществ по систематической номенклатуре наиболее важным является правильно определить число атомов углерода в наиболее длинной углеродной цепи или посчитать число атомов углерода в цикле.
Соединения, состоящие из одного атома углерода, будут иметь в своем названии корень мет,-; если углеродная цепь образована двумя атомами углерода — эт-, тремя атомами — пpoп-, четырьмя — бут-, пятью — пент-, шестью — гекс-, семью — гепт-, восемью — окт-, девятью — нон-, десятью — дек(ц)-.
Вторая важная составляющая, учитываемая при составлении названий, — наличие (или отсутствие) кратных связей или функциональной группы (см. табл. 6). Функциональная группа — атом или группа атомов, обуславливающих принадлежность вещества к тому или иному классу соединений, а также наиболее характерные химические свойства этого класса. Примерами функциональных групп могут служить: —ОН, —СООН, —NH2, —NО2И другие. Назовем вещество, имеющее строение:
![]()
1. В углеродной цепи данной молекулы три атома углерода, следовательно, корень в названии — “проп-”;
2. Отсутствие кратных связей говорит о предельном составе соединения, следовательно, суффикс будет “-ан”;
3. Наличие функциональной группы —ОН позволяет добавить к названию суффикс “-ол”.
4. В молекулах, содержащих кратные связи или функциональные группы, нумерация атомов углерода начинается с той стороны молекулы, к которой они ближе расположены. Название данного соединения пропанол-1.
Приведем еще один пример:
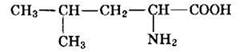
Наличие в углеродной цепи пяти атомов углерода определяет основной корень названия вещества “пент-”, отсутствие кратных связей — суффикс “-ан”. Нумерацию начинают от атома углерода в функциональной (карбоксильной) группе —СООН, которая определяет принадлежность этого вещества к классу карбоновых кислот, а следовательно, и окончание названия “-овая кислота”. У второго атома находится еще и аминогруппа (NH2—), следовательно, данное вещество относится к классу аминокислот. У четвертого атома углерода находится радикал метил (СН3—). Таким образом, название данного соединения по систематической номенклатуре
2-амино-4-метилпентановая кислота. Тривиальное название данного вещества — лейцин. Прямой связи со строением вещества тривиальные названия, как правило, не имеют. Таким образом, это особая система названий, предполагающая их целенаправленное запоминание.
Так, например, малоизвестное название “этановая кислота” в рамках тривиальной номенклатуры имеет вполне знакомое название — уксусная.
При выполнении заданий, проверяющих знание химических свойств органических веществ, необходимо исходить из состава и строения веществ, так как именно этим и определяются их свойства.
Определяющую роль в особенностях строения и свойств отдельных типов углеводородов играет вид гибридизации атомных орбиталей углерода. Гибридное состояние изменяется при переходе от одной разновидности углеводородов к другой. Общие характеристики углеводородов представлены в сводной таблице 7.
Таблица 7
|
Углеводороды |
Характеристика |
||||||
|
Общая формула |
Первый гомолог |
Вид гибридизации |
Вид ковалентной связи |
Длина связи С—С, нм |
Угол между связями |
Характерный тип реакции |
|
|
Алканы |
СnН2n+2 |
СН4 |
sp3 |
σс—с σс—н |
0,154 |
109°28' |
Замещение, разложение (крекинг) |
|
Циклоалканы |
СnН2n |
|
sp3 |
σс—с σс—н |
0,154 |
С3, С4 меньше 109°28' |
Присоединение |
|
С5, С6 и т.д. 109°28' |
Замещение |
||||||
|
Алкены |
СnН2n |
Н2С= CH2 |
sp2 |
σс—с σс—н πс—с |
0,134 |
120° |
Присоединение |
|
Алкины |
СnН2n-2 |
НС ≡ CH |
sp |
σс—с σс—н 2πс—с |
0,120 |
180° |
Присоединение |
|
Арены |
СnН2n-6 |
|
sp2 |
σс—с и σс—н 6π — электронное сопряжение в цикле |
0,140 |
120° |
Замещение |