Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола - Теоретический материал - ОРГАНИЧЕСКАЯ ХИМИЯ
К органическим гидроксисоединениям относятся вещества, содержащие одну или более гидроксильных групп —ОН, связанных с углеводородным радикалом.
В зависимости от характера углеводородного радикала эти соединения подразделяют на две большие группы: спиртыR—ОН, фенолы Аr—ОН.
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей: С—ОН с отщеплением ОН—группы и О—Н с отщеплением водорода.
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления, когда образуется двойная связь.
Полярный характер связей С—О и О—Н способствует протеканию реакций по ионному механизму. При разрыве связи О—Н с отщеплением протона (Н+) проявляются кислотные свойства гидроксисоединения, а при разрыве связи С—О — свойства основания и нуклеофильного реагента.
1. Реакции с разрывом связи О—Н
Одноатомные спирты реагируют с активными металлами (Na, К, Mg, Аl и др.), образуя соли — алкоголяты:
![]()
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла:
![]()
Спирты — более слабые кислоты, чем вода, так как алкильный радикал повышает электронную плотность на атоме кислорода и уменьшает полярность связи О—Н. Поэтому при взаимодействии спиртов со щелочами алкоголяты практически не образуются:
![]()
(равновесие этой реакции сдвинуто влево, так как соли спиртов в воде гидролизуются).
Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (индуктивный1 — I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов:
![]()
Такие спирты, в отличие от одноатомных, взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соединения, окрашивающие раствор в ярко-синий цвет (качественная реакция):
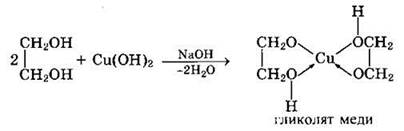
Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН) и не образуют окрашенного комплекса с Сu(ОН)2.
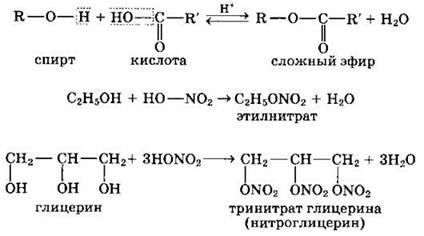
2. Реакции с кислотами (с образованием сложных эфиров)
Спирты вступают в реакции с органическими и минеральными кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс — гидролиз сложных эфиров).
3. Реакции окисления
В качестве окислителей спиртов обычно используют: КМnO4, К2Сr2O7 + H2S04, CuO, O2 + катализатор.
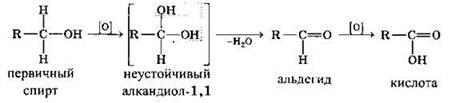
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
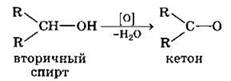
При окислении вторичных спиртов образуются кетоны.
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Предельное окисление гидроксисоединений до СO2 и Н2O происходит при их горении, например:
![]()
Полное окисление метанола идет по схеме:
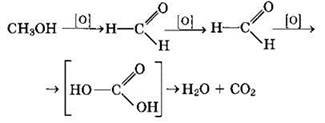
При сгорании спиртов выделяется большое количество теплоты.
![]()
4. Реакции замещения ОН-группы
Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора — сильной минеральной кислоты (например, H2SO4(KOHЦ.)). При этом спирты проявляют свойства слабых оснований.
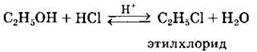
5. Реакции дегидратации спиртов
Отщепление воды от молекул спирта (дегидратация спиртов) в зависимости от условий происходит как внутримолекулярная или как межмолекулярная реакция.
Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при повышенной температуре.
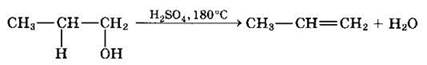
В тех случаях, когда возможны 2 направления реакции, например:
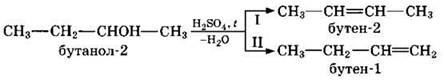
дегидратация идет преимущественно в I направлении, т.е. по правилу Зайцева — с образованием более замещенного алкена (водород отщепляется от менее гидрогенизированного атома углерода).
Межмолекулярная дегидратация спиртов с образованием простых эфиров происходит при более низкой температуре, чем внутримолекулярная реакция:
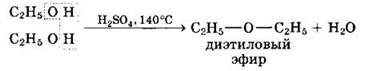
Фенолы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О—Н увеличивается.
1. Фенолы реагируют с металлическим натрием, образуя соли — феноляты.
![]()
2. Фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов:
![]()
3. Реакции фенола по бензольному кольцу
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (2, 4, 6-положения):
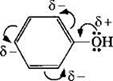
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения (SE) в ароматическом кольце.
а) Нитрование
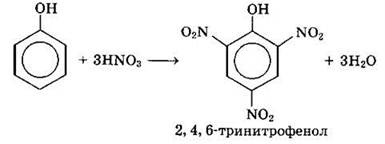
Под действием 20%-ной азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов:

При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
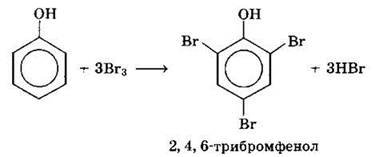
б) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол):
4. Для обнаружения фенолов используется качественная реакция с хлоридом железа (III) FeCl3. Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
1 Индуктивный эффект заключается в смещении электронов плотности в молекуле вдоль a-связи. При этом +I=эффект увеличивает электронную плотность на соседнем атоме, -I=эффект — уменьшает.