Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров - Теоретический материал - ОРГАНИЧЕСКАЯ ХИМИЯ
Альдегиды — органические соединения, в молекулах которых атом углерода карбонильной группы (карбонильный углерод) связан с атомом водорода.
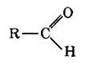
Общая формула R—СН = 0, где R = Н, алкил-, арил-
Функциональная группа —СН=0 называется альдегидной.
Кетоны — органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами:
![]()
где R, R' = алкил, арил
Присоединение большинства реагентов по двойной связи С = О происходит как ионная реакция по механизму нуклеофильного присоединения.
1. Присоединение спиртов с образованием полуацеталей (в присутствии кислоты или основания как катализатора):
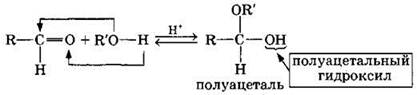
Полуацетали — соединения, в которых атом углерода связан с гидроксильной и алкоксильной (—OR) группами.
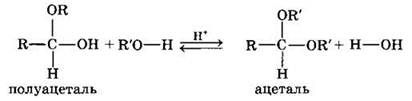
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
2. Реакции восстановления альдегидов и кетонов
Альдегиды при взаимодействии с водородом в присутствии Ni-катализатора образуют первичные спирты, кетоны — вторичные:

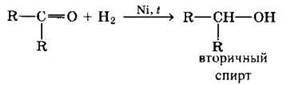
В лабораторных условиях для восстановления альдегидов и кетонов используется алюмогидрид лития LiAlH4.
3. Реакции окисления альдегидов и кетонов
Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием даже таких мягких окислителей, как оксид серебра и гидроксид меди (II).
Реакция “серебряного зеркала” — окисление аммиачным раствором оксида серебра:
![]()
Окисление гидроксидом меди (II) в составе комплекса с винной кислотой или с аммиаком (синий цвет) с образованием краснокирпичного осадка Сu2O:
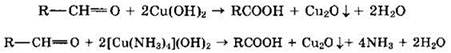
Данные реакции являются качественными на альдегидную группу.
Окисление формальдегида более сильным окислителем приводит к образованию углекислого газа:
![]()
А при окислении ацетальдегида образуется уксусная кислота:
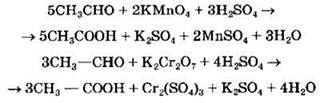
Карбоновые кислоты
Карбоновые кислоты — органические соединения, содержащие одну или несколько карбоксильных групп —СООН.
Карбоксильная группа содержит две функциональные группы — карбонил >С=0 и гидроксил —ОН, непосредственно связанные друг с другом:
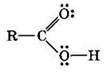
1. Образование солей происходит при действии на карбоновые кислоты:
а) активных металлов
![]()
б) аммиака
![]()
в) основных оксидов
![]()
г) гидроксидов металлов
![]()
д) солей более слабых кислот
![]()
Названия солей составляют из названий остатка RCOO- (карбоксилат-иона) и металла. Например, CH3COONa — ацетат натрия, (НСОО)2Са — формиат кальция, С17Н35СООК — стеарат калия и т.п.
Более сильные кислоты способны вытеснять карбоновые кислоты из их солей:
![]()
2. Образование сложных эфиров R—COOR':
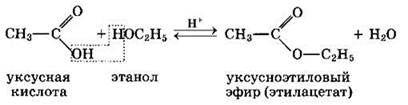
Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации (от лат. ether — эфир).
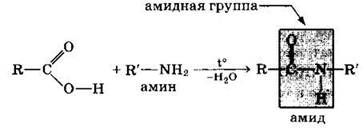
3. Образование амидов:

Вместо карбоновых кислот чаще используют их галоген- ангидриды:
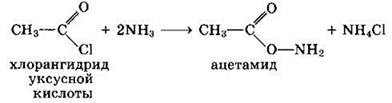
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
Сложные эфиры карбоновых кислот — соединения с общей формулой R—COOR’, где R и R’ — углеводородные радикалы.
Сложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.

Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс — расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта — называют гидролизом сложного эфира.
![]()
Гидролиз в присутствии щелочи протекает необратимо (так как образующийся отрицательно заряженный карбоксилат-анион RCOO- не вступает в реакцию с нуклеофильным реагентом — спиртом).

Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
Краткие названия сложных эфиров строятся по названию радикала (R') в остатке спирта и названию группы RCOO в остатке кислоты. Например, этиловый эфир уксусной кислоты СН3СООС2Н5называется этилацетат.
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов — основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
![]()