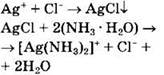Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Экспериментальные основы химии - Теоретический материал - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
|
№ |
Проверяемые элементы содержания |
|
1 |
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ. Качественные реакции на неорганические вещества и ионы. Идентификация органических соединений |
|
2 |
Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки |
|
3 |
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе |
|
4 |
Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси); если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного. Расчеты массовой доли (массы) химического соединения в смеси |
|
5 |
Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции |
|
6 |
Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ |
|
7 |
Нахождение молекулярной формулы вещества |
4.1. Теоретический материал
Экспериментальные основы химии
Правила работы в химической лаборатории, посуда и оборудование, техника безопасности при работе с едкими, горючими и токсичными веществами и средствами бытовой химии, а также методы разделения смесей и очистки веществ подробно рассматриваются в учебниках химии для средней школы; мы на них останавливаться не будем.
При выполнении заданий, проверяющих знание основных методов качественного анализа, существенную помощь могут оказать таблицы, содержащие перечень катионов и анионов, реактивов (или реакций), с помощью которых можно подтвердить наличие или отсутствие ионов в составе исследуемого вещества.
Таблица 8
Качественные реакции на катионы
|
Катион |
Реакция / реактив |
Наблюдаемая реакция |
|
|
Li+ |
Окрашивание пламени |
Карминово-красное окрашивание |
|
|
Na+ |
Окрашивание пламени |
Желтое окрашивание |
|
|
К+ |
Окрашивание пламени |
Фиолетовое окрашивание |
|
|
Са2+ |
Окрашивание пламени |
Кирпично-красное окрашивание |
|
|
Sr2+ |
Окрашивание пламени |
Карминово-красное окрашивание |
|
|
Ва2+ |
1) Окрашивание пламени 2) SO42- |
1) Желто-зеленое окрашивание; 2) Выпадение белого осадка, не растворимого в кислотах:
|
|
|
Сu2+ |
ОН- (щелочь) |
Выпадение осадка голубого цвета:
|
|
|
Pb2+ |
S2- |
Выпадение черного осадка:
|
|
|
Ag+ |
Cl- |
Выпадение белого осадка, не растворимого в HNO3, но растворимого в концентрированном NH3 ∙ Н2O:
|
|
|
Fe2+ |
1) ОН- (щелочь) 2) гексацианоферрат(III) калия (красная кровяная соль), K3[Fe(CN)6] |
1) Выпадение осадка зеленоватого цвета
2) Выпадение синего осадка:
|
|
|
Fe3+ |
1) ОН- 2) гексацианоферрат(II) калия (желтая кровяная соль) K4[Fe(CN)6] 3) роданид-ион SCN- |
1) Выпадение бурого осадка
2) Выпадение синего осадка:
3) Появление ярко-красного окрашивания за счет образования комплексных ионов Fe(SCN)2+, Fe(SCN)+2 |
|
|
Al3+ |
ОН- (щелочь) |
Выпадение осадка гидроксида алюминия при приливании первых порций щелочи и его растворение при дальнейшем приливании |
|
|
NH4+ |
ОН- (щелочь), нагревание |
Запах аммиака:
|
|
|
H+ (кислая среда) |
Индикаторы: лакмус, метиловый оранжевый |
Красное окрашивание растворов |
|
Таблица 9
Качественные реакции на анионы
|
Анион |
Реактив / реакция |
Наблюдаемая реакция |
|
SO42- |
Ва2+ |
Выпадение белого осадка, не растворимого в кислотах:
|
|
NО3- |
1) добавить конц. H2SO4 и Сu, нагреть 2) смесь H2SO4+ FeSO4 |
1) Образование голубого раствора, содержащего ионы Сu2+, выделение газа бурого цвета (NO2) 2) Возникновение окраски сульфата нитрозо-железа(II) [Fe(H2O)5NO]2+. Окраска от фиолетовой до коричневой (реакция “бурого кольца”) |
|
PO43- |
ионы Ag+ |
Выпадение светло- желтого осадка в нейтральной среде:
|
|
СrO42- |
ионы Ва2+ |
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в НСl:
|
|
S2- |
ионы Рb2+ |
Выпадение черного осадка:
|
|
СO32- |
ионы Са2+ |
Выпадение белого осадка, растворимого в кислотах:
|
|
CO2 |
известковая вода Са(ОН)2 |
Выпадение белого осадка и его растворение при пропускании СO2 |
|
SO32- |
ионы Н+ |
Появление характерного запаха SO2:
|
|
F- |
ионы Са2+ |
Выпадение-белого осадка:
|
|
Cl- |
ионы Ag+ |
Выпадение белого осадка, не растворимого в HNO3, но растворимого в конц. NH3 ∙ Н2O:
|
|
Br- |
ионы Ag+ |
Выпадение светло-желтого осадка, не растворимого в HNO3:
|
|
I- |
ионы Ag+ |
Выпадение желтого осадка, не растворимого в HNO3 и NH3 (конц.):
|
|
ОН- (щелочнаясреда) |
индикаторы: 1) лакмус 2) фенолфталеин |
1) синее окрашивание 2) малиновое окрашивание |
Таблица 10
Качественные реакции органических соединений
|
Соединение |
Реактив / реакция |
Наблюдаемая реакция |
|
Алканы |
Горение |
1) Низшие алканы горят голубоватым пламенем 2) Обычно определяют путем исключения |
|
Алкены |
1) Бромная вода (Вr2 р-р) 2) КМnO4 (р-р) 3) Горение |
1) Обесцвечивание раствора 2) Обесцвечивание раствора, выпадение бурого осадка МnO2 3) Горят желтоватым пламенем |
|
Бензол |
Горение |
Горит сильно коптящим пламенем. Обычно определяют путем исключения |
|
Фенол |
1) Бромная вода (Вr2 р-р) 2) р-р Na2CO3 3) FeCl3 |
1) Обесцвечивание, выпадение белого осадка трибромфенола 2) Выделение углекислого газа 3) Фиолетовое окрашивание |
|
Спирты |
1) Na 2) Горение 3) Черная горячая прокаленная медная проволока |
1) Выделение водорода 2) Горят светлым голубоватым пламенем 3) Восстановление красной окраски у прокаленной горячей медной проволоки |
|
Многоатомные спирты |
Сu(ОН)2 + NaOH |
Синее окрашивание — образование гликолятов и др. |
|
Амины |
1) Лакмус 2) HHal |
1) В водном растворе — синее окрашивание. 2) Образуют соли с галогеноводородами — после выпаривания образуется твердый осадок |
|
Анилин |
1) Бромная вода (Вr2 р-р) 2) HHal |
1) Обесцвечивание бромной воды, выпадение осадка триброманилина. 2) После упаривания твердый осадок — соль гидрогалогенида анилина. |
|
Альдегиды |
1) Ag2O 2) Cu(OH)2 |
1) Реакция “серебряного зеркала” 2) Выпадение красного осадка Сu2O |
|
Карбоновые кислоты |
Лакмус |
1) Красное окрашивание 2) Муравьиная — реакция “серебряного зеркала” 3) Олеиновая — обесцвечивание бромной воды |
|
Крахмал |
Раствор I2 в KI или спиртовой раствор иода |
Синее окрашивание |
|
Белки |
1) Конц. HNO3 2) щелочной раствор Сu(ОН)2 |
1) Желтое окрашивание 2) Фиолетовое окрашивание |